Inti Atom Dikelilingi Elektron; Pada awal kurun ke-20, antara 1906-1908 Sir Ernest Rutherford (1871-1937) menyampaikan bahwa partikel-partikel yang dipancarkan oleh materi radioaktif hampir seluruhnya sanggup menembus lembaran tipis metal, dan sangat sedikit partikel yang dipantulkan. Kejadian ini menciptakan Rutherford percaya bahwa sebagian besar dari suatu atom ialah berupa ruang kosong.
Fisikawan Ernest Rutherford menganalogikan bahwa atom menyerupai miniatur sistem tata surya, dengan elektron yang mengorbit di sekitar inti besar. Inti atom inilah yang memantulkan partikel radioaktif apabila kebetulan partikel ini menabrak inti atom; sementara partikel yang tidak menabrak inti atom akan melewati ruang kosong di sekitar inti atom. Partikel bermuatan positif yang berada dalam inti atom dinamakan senagai proton.
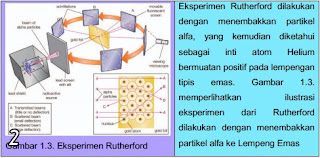
ATOM MODEL RUTHERFORD
Hasil eksperimen Rutherford membenarkan bahwa teori atom berdasarkan teori Thompson benar, bahwa sebagian besar berkas sinar alfa yang ditembakan dapat menembus lempengan emas dan sedikit sekali sinar yang akan dibelokkan.
Hasil tamat eksperimen yang dilakukan oleh Rutherford adalah, bahwa meskipun sebagian besar sinar alfa sanggup menembus lempeng emas, namun terdapat juga sejumlah besar sinar alfa yang dibelokkan dengan sudut belok yang besar, bahkan terdapat sinar alfa yang dikembalikan lagi tanpa pernah menyentuh detektor.
Berdasarkan hasil eksperimen tersebut, Rutherford menyimpulkan perihal teori atom, yakni sebagian besar sinar alfa yang menembus pelat tipis emas terjadi disebabkan sebagian besar atom ialah ruang kosong (terbuka).
- Sinar alfa yang dibelokkan dengan sudut besar terjadi lantaran mendekati inti atom.
- Sinar alfa yang dipantulkan kembali ialah sinar alfa yang menumbuk inti atom
Setelah inovasi Rutherford ini maka para ilmuwan menyadari bahwa atom bukan merupakan zat tunggal akan tetapi dibangun oleh subpartikel atom. Dengan penelitian selanjutnya mereka mengetahui bahwa inti atom bermuatan positif (dimana jumlah muatannya sama dengan nomor atom).Dan penelitian selanjutnya para ilmuwan menemukan bahwa jumlah elektron ialah sama dengan nomor atom, dengan demikian atom bermuatan netral (muatan positif = muatan negatifnya).
Kelebihan
Membuat hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti
Kelemahan
Hasil eksperimen Rutherford tidak sanggup menjelaskan mengapa elektron tidak bisa menabrak inti atom. Menurut teori fisika, gerakan elektron yang mengitari inti disertai pemancaran energi sehingga lama-kelamaan energi elektron akan berkurang dan lintasannya makin usang akan mendekati inti dan jatuh ke dalam inti.
ATOM MODEL BOHR
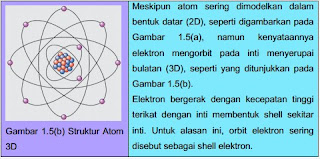
Inti Atom Dikelilingi Elektron; Berangkat dari gagasan Planck mengenai kuantisasi energi, pada 1913 Niels Bohr (1885-1962), seorang fisikawan Denmark, menyatakan bahwa elektron di dalam atom berada pada tingkat-tingkat energi tertentu.
Jika atom menyerap energi, elektron melompat ke tingkat energi yang lebih tinggi. Jika elektron kembali pada tingkat energi sebelumnya yang lebih rendah maka atom mengeluarkan energi. Tingkat-tingkat energi tersebut mempunyai nilai-nilai diskrit (terkuantisasi); peresapan dan pengeluaran energi juga terjadi secara diskrit. Atom dengan konsep ini disebut atom Bohr. Model atom Bohr bisa menjelaskan cukup baik atom hidrogen tetapi tidak bisa menjelaskan atom dengan banyak elektron dan juga tidak bisa menjelaskan ikatan atom. Walaupun model atom Bohr ternyata kurang memadai untuk menjelaskan banyak sekali tanda-tanda atom, namun langkah Bohr merupakan satu tahapan penting dalam perkembangan konsep atom. Kita akan meninjaunya biar memperoleh citra lengkap mengenai perkembangan pengertian perihal atom. Model atom yang dikemukakan oleh Bohr berbasis pada model yang diberikan oleh Rutherford, yaitu bahwa atom tersusun dari partikel-partikel. Partikel bermuatan positif berada di sentra atom, yang disebut inti atom, dan di sekeliling inti atom ini terdapat elektron-elektron yang bermuatan negatif dengan jumlah yang sama dengan muatan positif inti atom.
Gagasan mengenai energi yang diskrit ini intinya sama dengan gagasan yang telah dikemukakan oleh Planck serta Einstein. Model atom Bohr dikemukakan dengan memakai pendekatan mekanika klasik. Gambar 1.4. menyampaikan model atom Bohr dengan elektron dalam orbit di sekitar inti, yang terdiri dari proton dan neutron. Bayangan yang membentuk "ekor" pada elektron menyampaikan arah gerak.
Atom yang bermuatan positif menjadi fokus Rutherford untuk dikaji. Eksperimen yang dilakukan Rutherford ialah menembakan partikel alpha pada sebuah lempeng tipis dari emas, dengan partikel alpha. Hasil pengamatan Rutherford ialah partikel alpha yang ditembakan ada yang diteruskan, dan ada yang dibelokkan. Dari hasil eksperimen tersebut diketahui bahwa masih terdapat celah atau ruang kosong didalam atom, dan ada partikel yang bermuatan positif dan negatif.
ELEKTRON & KULIT ORBITAL
Level Energi-Elektron yang mengorbit inti atom pada jarak tertentu dari inti. Elektron yang letaknya orbitnya lebih bersahabat dari inti mempunyai energi yang lebih rendah daripada elektron yang letak orbitnya lebih jauh. Hanya nilai diskrit (terpisah dan berbeda) dari energi elektron yang ada dalam struktur atom. Oleh lantaran itu, elektron harus mengorbit pada jarak tertentu terpisah dari inti.Setiap jarak diskrit (orbit) dari inti sesuai dengan tingkat energi tertentu. Dalam atom, orbit dikelompokkan kedalam tingkat energi yang lebih dikenal sebagai kulit/lapisan. Sebuah atom tertentu mempunyai nomor kulit yang tetap. Masing-masing kulit mempunyai jumlahelektron maksimum yang tetap.
Jumlah maksimum Elektron di setiap kulit. Jumlah maksimum elektron (Ne) yang terdapat di setiap kulit atom ialah fakta alam dan sanggup dihitung dengan memakai rumus,
Jumlah maksimum nomor elektron yang berada dalam kulit terdalam (kulit-1) adalah,
Jumlah maksimum nomor elektron yang berada dalam lapisan kulit-2 adalah,
Jumlah maksimum nomor elektron yang berada dalam lapisan kulit-3 adalah,
Jumlah elektron yang menghuni pada orbit ke-4, ke-5 dan seterusnya tidak sanggup menampung lebih dari 32 elektron. Tiga puluh dua elektron ialah jumlah maksimum elektron yang sanggup tertampung dalam setiap orbit:
ELEKTRON VELENSI
Elektron yang berada di orbit lebih jauh dari inti mempunyai energi yang lebih tinggi dan kurang terikat erat dengan inti atom daripada elektron yang berada lebih bersahabat dengan inti atom. Dengan semakin jauh jarak antara elektron dengan inti atom, menyebabkan gaya tarik-menarik antara inti yang bermuatan positif dan elektron yang bermuatan negatif menjadi semakin lemah (menurun). Elektron dengan energi tertinggi ada di kulit terluar dari atom dan relatif tidak terikat (bebas) dengan inti atom. Kulit terluar ini yang dikenal sebagai kulit valensi atau disebut juga dengan elektron valensi. Elektron valensi ini berkontribusi terhadap reaksi kimia dan ikatan dalam struktur suatu material dan memilih sifat dari kelistrikan. Aliran listrik terjadi, ketika sebuah elektron valensi memperoleh energi yang cukup dari sumber eksternal, dan seketika sanggup membebaskan diri dari ikatan atom. Peristiwa lepasnya elektron valensi dari ikatan atom merupakan dasar untuk konduksi dalam suatu bahan.
TABEL PERIODIK
Unsur-unsur dalam sistem periodik sanggup dikelompokan menjadi dua katagori, yaitu kelompok arah sumbu vertikal diberi nama kelompok “perioda” yang terdiri dari 7 perioda, sedangkan untuk kelompok kearah sumbu horisontal dinamakan kelompok “golongan” yang terdiri atas 2 golongan yaitu A dan B.
- Golongan 1A hingga dengan VIIIA disebut golongan utama.
- Golongan IB hingga VIIB dan VIIIB dinamakan golongan transisi.
- Unsur-unsur Golongan A dinamakan unsur-unsur representatif (utama) yang terdiri dari 8 golongan IA – VIIIA.
- Unsur-unsur golongan B dinamakan unsur-unsur transisi yang terdiri dari 8 golongan, yaitu golongan IB-VIIIB.
Golongan A mempunyai konfigurasi lapisan kulit elektron paling luar ,
 dimana:
dimana:- Pangkat menyampaikan representasi jumlah elektron pada lapisan kulit paling luar
- menunjukkan periode ( n )
- Jumlah elektron pada lapisan kulit paling luar menyampaikan golongan
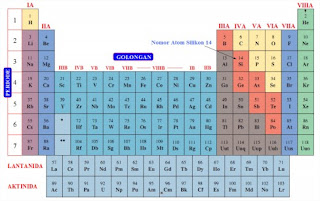 | |||
| Gambar 1.6(a). Tabel periodik unsur-unsur dan beberapa tabel menyampaikan dari massa atom. |
PENGGUNAAN TABEL PERIODIK
Nomor Atom (Atomic Number): Semua atom dari unsur yang sama memiliki
jumlah proton yang sama, atom dari elemen yang berbeda memiliki jumlah
proton yang berbeda. Nomor atom suatu unsur yang didefinisikan sebagai
jumlah proton dalam setiap atom dari elemen.
 |
| Gambar 1.6(b). Tabel Periodik Elemen & Blok Orbit Shell |
Elemen yang tercantum dalam grafik yang disebut pada tabel periodik (Gambar 1.6(a) dan 1.6(b) menunjukkan meningkatkan nomor atom (dari kiri-ke-kanan, dan dari atas-ke-bawah). Untuk memudahkan pengertian, untuk itu setiap tunjangan nama elemen diberi simbol yang berasal dari nama elemen tersebut. Simbol abjad pertama ditulis dengan abjad kapital dan simbol untuk abjad keduaharus ditulis dalam abjad kecil. Misalnya, simbol untuk oksigen (O), dan untukmagnesium, dinyatakan dalam (Mg).